转载自@咸达数据公众号
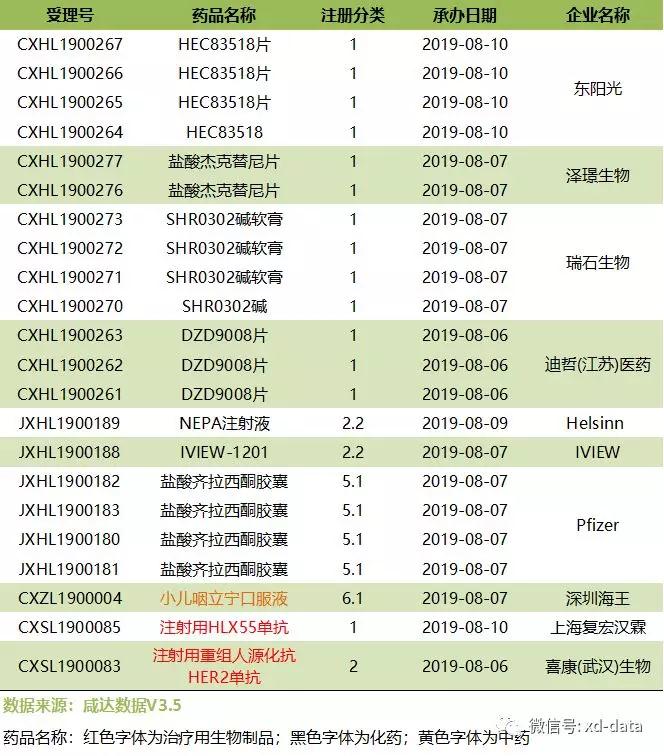
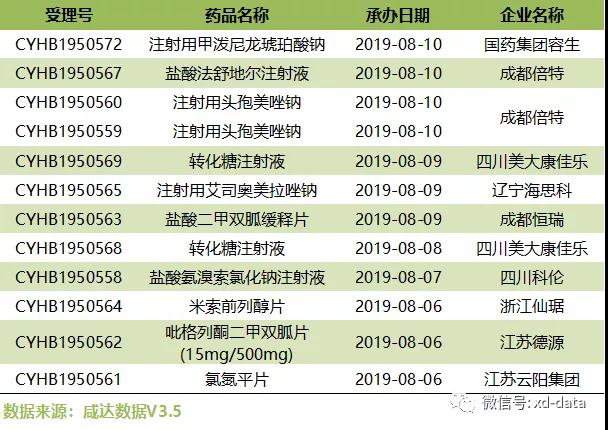
根据咸达数据,近一周(2019.8.5-8.11)1个新药申报生产处于制证阶段;10个新药申报临床已获CDE承办;1个新药申报上市已获CDE承办;11个品种提交一致性评价申请。
| 看点一
吉利德申报的进口化药比克替拉韦/恩曲他滨/丙酚替诺福韦片,上市申请已审评完毕,处于在制证阶段。本品受理号JXHS1800065。
本品是吉利德研发的三合一的复方剂型,每片含比克替拉韦钠相当于50mg比克替拉韦、200mg恩曲他滨和富马酸丙酚替诺福韦相当于25mg丙酚替诺福韦。本品于 2018 年 2 月 7 日获美国 FDA 批准上市,用于治疗 HIV-1 感染。此次在我国申报上市的适应症同FDA。
| 看点二
近一周CDE承办的首次申报临床的新药品种共计10个,详情如下:
部分品种的详细信息如下:
SHR0302碱软膏:本品是是一种小分子JAK1激酶选择性抑制剂,拟用于溃疡性结肠炎的治疗。SHR0302片的同类产品有辉瑞公司开发的托法替尼。于2018年10月获FDA批准临床试验。
NEPA注射液:本品是复方奈妥吡坦和帕洛诺司琼冻干粉注射剂。帕洛诺司琼是一种5-HT3受体拮抗剂,对该受体具有很强的结合亲和力,对其他受体的亲和力很小或没有。奈妥吡坦是人类P物质/神经激肽1(NK-1)受体的选择性拮抗剂。本品有胶囊剂和注射粉针剂,分别于2014年和2018年在美国上市。适应症为化疗后恶心呕吐治疗。
IVIEW-1201:本品是由IVIEWTherapeutics研发的,聚维酮碘缓释滴眼剂,治疗由细菌、分枝杆菌、病毒、真菌或阿米巴原虫引起的结膜和角膜的感染。本品目前在美国、印度等地进行临床试验。
注射用HLX55单抗:本品用于转移性或复发性实体瘤治疗的临床试验。其余信息暂未披露。
| 看点三
绿十字申报的进口治疗用生物制品艾度硫酸酯酶β注射液,上市申请已获CDE承办,受理号JXSS1900046。
本品为一种酶替代的疗法产品,用于治疗Type-2黏多糖贮积症,又称Hunter综合征。大约每10万~15万新生儿中有一例患有这种罕见病。2012年7月本品在韩国获得孤儿药身份上市。
| 看点四
近一周提交一致性评价的品种,共计11个,如下:
作者| 米琥、横颜
编辑| 米琥